Newsletter Alzheimer #5 - Maladies Neurodégénératives
Nous sommes heureux de vous présenter la cinquième newsletter de la Fondation pour la Recherche Médicale sur les maladies neurodégénératives.
Cette newsletter est prioritairement destinée aux lauréats du « premier axe prioritaire » de la FRM c’est-à-dire aux lauréats des appels à projets Alzheimer de 2019 et Maladies Neurodégénératives de 2020 – mais n’hésitez pas à la partager si vous le souhaitez. Les trois premières newsletters centrées sur la maladie d’Alzheimer n’ont été envoyées qu’aux lauréats de l’APP 2019, n’hésitez pas, pour ceux qui ne les ont pas reçues, à nous contacter si vous souhaitez les recevoir.
Au programme de cette newsletter :![]() les publications récentes de chercheurs lauréats du « premier axe prioritaire »
les publications récentes de chercheurs lauréats du « premier axe prioritaire »
![]() les derniers résultats d’essais cliniques de phase 3 dans le domaine des maladies neurodégénératives ainsi que ceux attendus pour la fin de l’année
les derniers résultats d’essais cliniques de phase 3 dans le domaine des maladies neurodégénératives ainsi que ceux attendus pour la fin de l’année![]() les changements qu’apporte la loi PACTE dans le statut du chercheur-entrepreneur
les changements qu’apporte la loi PACTE dans le statut du chercheur-entrepreneur![]() des webinaires sur la valorisation de la recherche prévus pour septembre 2021
des webinaires sur la valorisation de la recherche prévus pour septembre 2021
Nous vous souhaitons une bonne lecture !
Les actualités au sein du réseau « premier axe prioritaire FRM »
Focus sur 2 articles récemment publiés par des lauréats du « premier axe prioritaire ». Bravo à eux pour ces publications !
Chronic Sodium Selenate Treatment Restores Deficits in Cognition and Synaptic Plasticity in a Murine Model of Tauopathy![]() Ahmed et al.; Front Mol Neurosci. 2020 Oct 8 doi: 10.3389/fnmol.2020.570223.
Ahmed et al.; Front Mol Neurosci. 2020 Oct 8 doi: 10.3389/fnmol.2020.570223.
 Luc Buée, porteur du projet
Luc Buée, porteur du projet
Cette étude montre qu’un traitement de 3 mois de sélénate de sodium, un activateur de la protéine phosphate 2A (PP2A), chez un modèle murin transgénique de tauopathie restaure les fonctions cognitives
De plus, ce traitement réduit l'activité de la sous-unité catalytique de la PP2A sans affecter la PP2A totale. Cette étude renforce l’idée que l’impact négatif de la pathologie Tau sur la plasticité et la mémoire est probablement dû aux espèces Tau solubles non agrégées. Le sélénate de sodium pourrait donc être un candidat pour des essais cliniques ciblant la pathologie Tau.
Atomic Force Microscopy Imaging and Nanomechanical Properties of Six Tau Isoform Assemblies![]() Maki et al. ; Biophys J. 2020 Dec 15; doi: 10.1016/j.bpj.2020.10.045.
Maki et al. ; Biophys J. 2020 Dec 15; doi: 10.1016/j.bpj.2020.10.045.
 Dans cette étude, des fibrilles amyloïdes de Tau ont été générées à partir de 6 isoformes de protéines Tau. Quel que soit l’isoforme, les fibrilles présentent une structure de filaments hélicoïdaux appariés. Les inserts N-terminaux ne contribuent pas à des différences morphologiques ou mécaniques entre les formes filamenteuses des isoformes de Tau alors que les fibrilles constituées des isoformes comportant 4 domaines de liaison aux microtubules sont deux fois plus rigides que celles en comportant 3. Enfin, les faibles valeurs de modules d’élasticité suggèrent que les liaisons entre les molécules de Tau sous une forme béta plissée dans les filaments et qui jouent un rôle important dans la stabilité des filaments mais aussi dans leurs mécanismes de toxicité et de propagation sont faibles. Des études supplémentaires restent à mener pour documenter ce dernier aspect. Ronald Melki, chef d’équipe du projet FRM « Nouveaux mécanismes physiopathologiques impliqués dans la maladie d'Alzheimer»
Dans cette étude, des fibrilles amyloïdes de Tau ont été générées à partir de 6 isoformes de protéines Tau. Quel que soit l’isoforme, les fibrilles présentent une structure de filaments hélicoïdaux appariés. Les inserts N-terminaux ne contribuent pas à des différences morphologiques ou mécaniques entre les formes filamenteuses des isoformes de Tau alors que les fibrilles constituées des isoformes comportant 4 domaines de liaison aux microtubules sont deux fois plus rigides que celles en comportant 3. Enfin, les faibles valeurs de modules d’élasticité suggèrent que les liaisons entre les molécules de Tau sous une forme béta plissée dans les filaments et qui jouent un rôle important dans la stabilité des filaments mais aussi dans leurs mécanismes de toxicité et de propagation sont faibles. Des études supplémentaires restent à mener pour documenter ce dernier aspect. Ronald Melki, chef d’équipe du projet FRM « Nouveaux mécanismes physiopathologiques impliqués dans la maladie d'Alzheimer»
Où en sont les essais cliniques sur les maladies neurodégénératives ?
Vous vous demandez surement si les résultats d’essais cliniques de phase 3 annoncés dans la NL#3 pour fin 2020 - début 2021 ont bien été annoncés. Voici donc une sélection parmi les principaux résultats publiés depuis novembre 2020 et les résultats attendus d’ici 2022.
- 7 juin 2021 : Autorisation conditionnelle par la FDA de l’aducanumab (Biogen)
La FDA a annoncé l’autorisation « accélérée » d’aducanumab, un traitement de la maladie d’Alzheimer et réclame un essai post-approbation d’une durée de 9 ans afin de vérifier les bénéfices cliniques du médicament. L’aducanumab est un anticorps monoclonal anti-amyloïde qui réduit la charge amyloïde dans le cerveau. De par l’historique de cette étude clinique qui avait été prématurément interrompue en 2019 et pour laquelle la commission des experts indépendants de la FDA a rendu un avis négatif en novembre, la décision prise par la FDA n'a pas fait l'unanimité chez la communauté scientifique. Suite à ces controverses, la FDA a annoncé le 7 juillet 2021 avoir modifié les recommandations d'utilisation du médicament qui est maintenant indiqué pour "des patients aux déficiences cognitives modérées ou à une phase de démence modérée de la maladie". L’aducanumab n’est autorisée qu’aux Etats-Unis, l’EMA (European Medicines Agency) rendra son avis d’ici fin 2021.
Sources : FDA : Aducanumab Information ; France Alzheimer : Focus sur l’aducanumab ; FCM : Aducanumab : épisode VII, l’approbation par la FDA ; The Economist : America’s wary approval of an Alzheimer’s drug offers hope to millions ; Le Quotidien du Médecin : la FDA restreint l'aducanumab aux cas les moins avancés
![]() 5 avril 2021 : Rejet par la FDA (US Food & Drug Administration) de l’extension d’indication de la pimavansérine (ACADIA)
5 avril 2021 : Rejet par la FDA (US Food & Drug Administration) de l’extension d’indication de la pimavansérine (ACADIA)
La FDA a rejeté la demande d’approbation d’Acadia Pharmaceuticals pour le Nuplazid (pimavansérine) comme traitement des délires et hallucinations de patients atteints de démence au sens large. Acadia Pharmaceuticals estime que cette décision est contradictoire avec les retours précédents de de la FDA et est en désaccord avec l’approche de la FDA pour évaluer les patients atteints de démence.![]() 18 janvier 2021 : publication des premiers résultats de l’essai clinique de phase 2/3 du troriluzole (Biohaven)
18 janvier 2021 : publication des premiers résultats de l’essai clinique de phase 2/3 du troriluzole (Biohaven)
Biohaven Pharmaceutical a publié les grandes lignes des résultats de l’essai clinique phase 2/3 du troriluzole comme un traitement symptomatique des formes légères à modérées de la maladie d’Alzheimer. Le traitement ne fonctionne pas mieux qu’un placebo dans les mesures de cognition et de démence à 48 semaines. Les résultats complets de cette étude sont attendus dans les prochains mois.![]() 18 novembre 2020 : dernière visite de patients de l’essai clinique de phase 3 de l’ALZT-OP1 (AZTherapies)
18 novembre 2020 : dernière visite de patients de l’essai clinique de phase 3 de l’ALZT-OP1 (AZTherapies)
AZTherapies a annoncé que la dernière visite de patients de l’essai clinique de phase 3 COGNITIVE évaluant la sécurité et l’efficacité d’ALZT-OP1, un traitement pour les patients atteints de la maladie d’Alzheimer à un stade précoce était terminée et que l’analyse des données allait bientôt commencer. ALZT-OP1 est une combinaison de 2 molécules déjà commercialisées dans d’autres indications qui vise à mettre les microglies dans un état neuroprotecteur, réduisant ainsi la neuroinflammation.
- Et quels sont les résultats attendus pour les prochains mois ?
![]() Septembre 2021 : résultats de l’essai clinique phase 3 du Valbenazine (Neurocrine Biosciences)
Septembre 2021 : résultats de l’essai clinique phase 3 du Valbenazine (Neurocrine Biosciences)
La Valbenazine est un inhibiteur de VMAT2 approuvé par la FDA pour le traitement de patients atteints de dyskinésie tardive. Cet essai clinique testera son efficacité sur la chorée associée à la maladie de Huntington.
![]() Septembre 2021 : résultats de l’essai clinique phase 3 de l’oxycodone PR et de la lévodopa (CHU, Toulouse)
Septembre 2021 : résultats de l’essai clinique phase 3 de l’oxycodone PR et de la lévodopa (CHU, Toulouse)
Cette étude évalue les effets antalgiques de l’oxycodone et de la lévodopa sur la douleur neuropathique centrale chronique causée par la maladie de Parkinson. Ils seront administrés en plus du traitement antiparkinsonien habituel.
Connaissez-vous la loi PACTE ? Elle permet, depuis 2020, de faciliter la vie du chercheur-entrepreneur
La loi PACTE (Plan d'action pour la croissance et la transformation des entreprises), adoptée en 2019, a pour but de donner les moyens nécessaires aux entreprises pour innover, se transformer, grandir et créer des emplois. Dans la suite, nous vous présentons les principales mesure de cette loi au sujet du statut de chercheur-entrepreneur et de la protection de la propriété intellectuelle.
La loi Allègre adoptée en 1999 avait pour objectif de favoriser la collaboration entre recherche publique et entreprises. Cependant, les 3 principaux dispositifs prévus par cette loi (Article 25-1 : création d’entreprise, Article 25-2 : apport d’un concourt scientifique et Article 25-3 : participation à la gouvernance) étaient jugés complexes et trop rigides. L’article 41 du projet de loi PACTE dont la plupart des mesures sont entrées en application en janvier 2020, vise à simplifier les procédures, à prendre en compte la diversité des situations existantes et à fluidifier les passages d’un dispositif à l’autre afin de créer davantage de passerelles entre le monde de la recherche et celui de l’entreprise.
Le tableau AVANT (loi Allègre) / APRES (article 41 de la loi PACTE) présente les évolutions des différents dispositifs du statut du chercheur-entrepreneur.
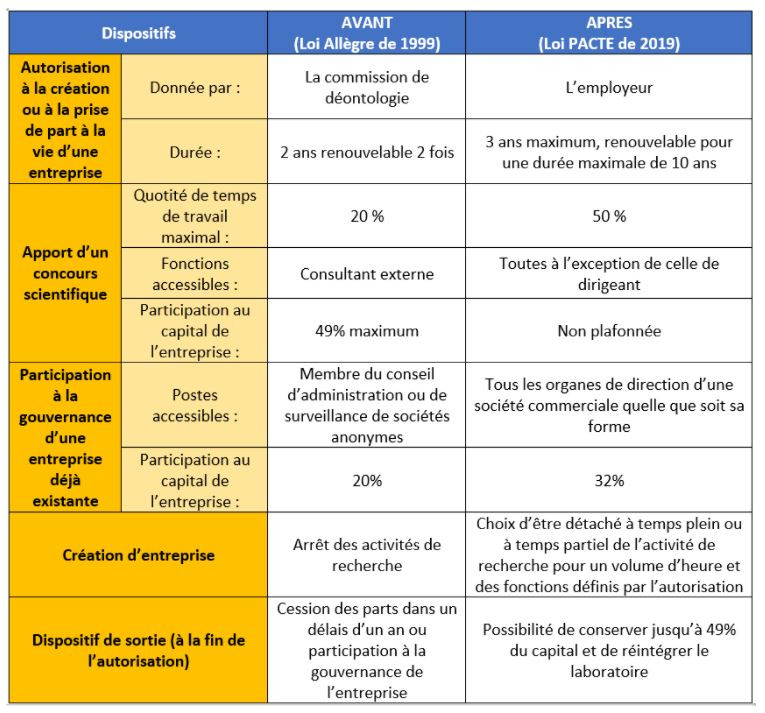
La loi PACTE prévoit également des mesures relatives à la propriété intellectuelle (articles 40 et 42). En voici les principales :
- L’allongement du certificat d’utilité de 6 à 10 ans qui peut être transformé en demande de brevet.
- La création d’une demande provisoire de brevet : le déposant peut ainsi se prévaloir d’une date de priorité et détailler ultérieurement ses revendications, dans un délai maximum d’un an. Il peut également choisir d’abandonner sa demande au terme du délai si celle‑ci ne répond plus à ses besoins.
- La création d’une procédure d’opposition aux brevets d’invention devant l’Institut national de la propriété industrielle (INPI) permettant de renforcer la sécurité juridique du brevet et de simplifier la procédure pouvant conduire à annuler les titres.
- Le renforcement de la procédure d’examen des brevets qui amènera l’INPI à procéder à un contrôle approfondi de la brevetabilité de l’invention, notamment le critère d’activité inventive et améliorera ainsi la confiance dans le système français des brevets.
Sources : Grenoble INP - UGA : Loi sur l’innovation ; Assemblée Nationale : Projet de loi ; Assemblée Nationale : Etude d’impact ; INPI : Loi pacte : La propriété intellectuelle s’adapte aux nouvelles attentes des entreprises
Vous souhaitez en connaitre plus sur la valorisation de la recherche ?
Voici quelques Webinaires prévus pour septembre qui pourront vous intéresser !
7 septembre 2021 : ![]() « La propriété industrielle sans frontières » par France Innovation
« La propriété industrielle sans frontières » par France Innovation
16 septembre 2021 : ![]() « Panorama des aides à la création d'entreprise » par Bpifrance Création
« Panorama des aides à la création d'entreprise » par Bpifrance Création
Photo : contenu gratuit Canva

Commentaires0
Veuillez vous connecter pour lire ou ajouter un commentaire
Articles suggérés


